نيتروجين
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
عديم اللون في الحالات الثلاثة، الغازية والسائلة والصلبة. الخطوط الطيفية للنيتروجين | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
الاسم، العدد، الرمز | نيتروجين، 7، N | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
تصنيف العنصر | لا فلز | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
المجموعة، الدورة، المستوى الفرعي | 15، 2، p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
الكتلة الذرية | 14.0067 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
توزيع إلكتروني | 1s2 2s2 2p3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 5 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
الطور | غاز | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
الكثافة | (0 °س، 101.325 كيلوباسكال) 1.251 غ/ل | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
كثافة السائل عند نقطة الغليان | 0.808 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
نقطة الانصهار | 63.153 ك، -210.00 °س | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
نقطة الغليان | 77.36 ك، -195.79 °س | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
نقطة ثلاثية | 63.1526 كلفن (-210°س)، 12.53 كيلوباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
النقطة الحرجة | 126.19 ك، 3.3978 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
حرارة الانصهار | N2) 0.72) كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
حرارة التبخر | N2) 5.56) كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
السعة الحرارية (عند 25 °س) | (N2) 29.124 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
أرقام الأكسدة | 5، 4، 3، 2، 1، -1، -2، -3 (أكاسيده حمضية) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
الكهرسلبية | 3.04 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
طاقات التأين | الأول: 1402.3 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 2856 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 4578.1 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
نصف قطر تساهمي | 1±71 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
نصف قطر فان دير فالس | 155 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
البنية البلورية | نظام بلوري سداسي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
المغناطيسية | مغناطيسية معاكسة | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
الناقلية الحرارية | 25.83 × 10−3 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
سرعة الصوت | (غاز، 27 °س) 353 متر/ثانية | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
رقم الكاس | 7727-37-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر النيتروجين | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
النيتروجين (أو الآزوت) هو عنصر كيميائي رمزه N وعدده الذري 7، ويقع ضمن عناصر الدورة الثانية وعلى رأس المجموعة الخامسة عشر في الجدول الدوري وذلك كعنصر مجموعة رئيسي، حيث أن مجموعته تسمّى باسمه مجموعة النتروجين. يصنف النتروجين ضمن اللافلزات، ويكون في الشروط العادية من الضغط ودرجة الحرارة على شكل N2 وهو غاز ثنائي الذرة، وعديم اللون والطعم والرائحة.
النتروجين عنصر شائع في الكون، حيث يدخل في تركيب درب التبانة والمجموعة الشمسية، وعلى كوكب الأرض يشكّل غاز النتروجين 78% من الغلاف الجوي للأرض، وبالتالي هو أكثر العناصر الكيميائية النقية من حيث الوفرة؛ أما في القشرة الأرضية، فمن النادر أن يوجد عنصر النتروجين على شكل أملاح لاعضوية. بالمقابل، يدخل عنصر النتروجين في الطبيعة -بشكل عضوي- في تركيب جميع الأنسجة الحيّة، وذلك بشكل أساسي في الأحماض الأمينية (وبالتالي في البروتينات)، وكذلك في الأحماض النووية حمض نووي ريبوزي منقوص الأكسجين وحمض نووي ريبوزي؛ وفي الصناعة يشكّل النتروجين العديد من المركّبات المهمة كالأمونيا وحمض النتريك والسيانيد، ويدخل أيضاً كعنصر مهم في صناعة الأسمدة.
محتويات
1 التاريخ وأصل التسمية
2 الوفرة الطبيعية
3 الإنتاج والتحضير
4 النظائر
5 الخواص الفيزيائية
6 الخواص الكيميائية
6.1 المركبات الكيميائية
7 الدور الحيوي
8 الاستخدامات
8.1 غاز النتروجين
8.2 النتروجين السائل
8.3 مركبات النتروجين
9 احتياطات الأمان
10 المراجع
11 وصلات خارجية
التاريخ وأصل التسمية

دانيال رذرفورد، ينسب إليه اكتشاف عنصر النتروجين
عرفت مركبات النتروجين منذ العصور الوسطى، فقد عرف جابر بن حيان حمض النتريك باسم ماء النار (aqua fortis)، كما عرف الماء الملكي (aqua regia)، وهو مزيج من حمض النتريك مع حمض الهيدروكلوريك، وسمي بالملكي لقدرته على إذابة الذهب. استعملت مركبات النتروجين لاحقاً في تحضير البارود ثم في صناعة الأسمدة.
اكتشف غاز النتروجين من قبل العالم دانيال رذرفورد سنة 1772، والذي أسماه حينها الهواء المضر أو المؤذي noxious air،[1][2] وذلك على الرغم من أنه لم يكن يعتبره كعنصر كيميائي مستقل، لكنه ميّزه عن الهواء المُثَبَّت، والذي كان يقصد به غاز ثنائي أكسيد الكربون في تلك الأحيان، حيث أن حقيقة أن هناك مكوّن للهواء لا يساعد على الاحتراق كانت معروفة بالنسبة لرذرفورد.[3] في الوقت نفسه تقريباً، دُرس النتروجين من قبل العلماء كارل فلهلم شيله وهنري كافنديش وجوزيف بريستلي، والذين أقروا أن النتروجين جزء من الهواء، وأشاروا إليه باسم الهواء المحروق أو هواء الفلوجستون. بالمقابل، قام أنطوان لافوازييه بتسمية ذلك الغاز الخامل الذي يطفئ اللهب ويميت الحيوانات باسم آزوت azote، وذلك من الكلمة الإغريقية ἄζωτος آزوتوس بمعنى لا حياة.[4] ولا يزال يشار إلى عنصر النتروجين باسم الآزوت في بعض اللغات مثل الفرنسية والإيطالية والروسية والتركية. بالمقابل يشار إلى هذا العنصر في اللغة الألمانية باسم Stickstoff، بمعنى المادة المطفئة للهب.

جان أنطوان شابتال، مبتدع لفظ نتروجين
أما كلمة نتروجين فقد ابتدعت من الكيميائي جان أنطوان شابتال وذلك من الإغريقية νίτρον نطرون (والتي كانت تشير إلى مصطلح يشمل ملح النتر، وفي الوقت نفسه إلى كربونات الصوديوم، إذ لم يكن يميز بينهما)، ومن -γενής جين بمعنى مولّد؛ أي أن الكلمة تحمل معنى مولّد النتر. كان شابتال يريد بذلك الإشارة إلى النتر، وهي المادة الكيميائية (نترات البوتاسيوم) التي كانت لازمة من أجل إنتاج حمض النتريك، والذي كان قد اكتشف أنه يحوي على غاز النتروجين.[5]
مع تطور البحث العلمي، دخل النتروجين في العديد من التجارب الفيزيائية والكيميائية. ففي سنة 1910 قام جون ويليام ستروت، المعروف باسم لورد رايلي، بالقيام بتجربة اكتشف فيها النتروجين الفعّال، وهو تعبير استخدمه للإشارة إلى النتروجين الذرّي، والذي هو عبارة عن متآصل أحادي الذرة للنتروجين تحصّل عليه في جهاز أنبوب التفريغ على شكل غمامة ذات لون أصفر ساطع. لم يدم التشكل طويلاً، إذ سرعان ما تفاعل بدوره بشكل انفجاري مع الزئبق، حيث تشكّل نتريد الزئبق.[6]
أدى تطوّر التقنيات الصناعية إلى ظهور تقنيات سهّلت من عملية تثبيت النتروجين مثل عملية فرانك-كارو (1895–1899) وعملية أوستفالد (1902) وعملية هابر-بوش (1908–1913)، مما سهّل من إمكانية استحصال مركبات النتروجين المختلفة.[7]
الوفرة الطبيعية
يشكّل غاز النتروجين (N2) أكبر نسبة في الغازات المكوّنة للغلاف الجوّي للأرض، حيث أنّ نسبته تبلغ 78.08% حجماً في الهواء الجاف، و75.53% وزناً في الهواء الجاف.[8] أمّا في القشرة الأرضية فإن النتروجين قليل الوفرة الطبيعية نسبياً، إذ أن المعادن الحاوية على النتروجين غالباً ما تكون على شكل أملاح مثل نترات البوتاسيوم (ملح بيتر) أو نترات الصوديوم (ملح تشيلي) أو كلوريد الأمونيوم (ملح النشادر)، وجميع هذه الأملاح منحلّة، لذلك يندر وجود ترسبات معدنية منها.
إن النتروجين هو عنصر شائع الانتشار في الكون، إذ يقدّر أن ترتيبه السابع من حيث وفرة العناصر الكيميائية بالنسبة لكتلتها في درب التبانة.[9] ينشأ عنصر النتروجين في الكون نتيجة تفاعلات الانصهار النجمي وذلك من عنصري الهيدروجين والكربون في المستعرّات الأعظمية،[9] وفي النجوم عن طريق دورة CNO.[10] اكتشفت آثار من النتروجين الجزيئي ومركّبات النتروجين في الوسط بين النجمي وذلك باستخدام المقراب الفضائي (FUSE).[11] كما يدخل النتروجين الجزيئي في تركيب الغلاف الجوي لقمر تيتان الذي يدور في فلك كوكب زحل.[12]
يدخل النتروجين في تركيب كافة المتعضيات الحية، فهو مكوّن أساسي للبروتينات والأحماض النووية، وجزيئات حيوية أخرى مثل الإنزيمات. يشكّل النتروجين عادةً ما بين 2 - 6% من الوزن الجاف للمادة النباتية، ووسطياً حوالي 1.5%.[13] يوجد النتروجين بكميّات وفيرة في فضلات الحيوانات وذرق الطيور، وذلك على شكل يوريا وحمض اليوريك وعلى شكل أملاح الأمونيوم.
الإنتاج والتحضير

مخطط يظهر طريقة الحصول على النتروجين بطريقة الغشاء التناضحي العكسي.
يصنّف غاز النتروجين من ضمن الغازات الصناعية، التي لها تطبيقات مهمة، وينتج عن طريق إسالة الهواء بالضغط والتبريد ثم التقطير التجزيئي للهواء السائل لفصل غازي الأكسجين والنتروجين وذلك حسب عملية ليندة. أو عن طريق استخدام وسائل ميكانيكية باستخدام الهواء الغازي، أي باستخدام امتزاز تأرجح الضغط أو غشاء تناضحي عكسي. تتم الطريقة الأخيرة عن طريق تمرير الهواء بضغط مرتفع يتراوح بين 5 إلى 12 بار عبر غشاء اصطناعي، وبما أن سرعة الانتشار لغازات النتروجين والآرغون عبر تلك الأغشية هي أبطأ من التي لغازات الأكسجين وبخار الماء وثنائي أكسيد الكربون، فإن غاز النتروجين بالتالي يزداد تركيزه في الطرف الداخلي للغشاء، وبإجراء ضبط لسرعة التدفق، يمكن الحصول على غاز النتروجين بنقاوة تصل إلى 99%.
تعد وسيلة تقطير الهواء الأسلوب التجاري للحصول على النتروجين، والذي يحصل عليه غالباً كناتج ثانوي من عملية إنتاج غاز الأكسجين، وذلك من أجل الصناعات المختلفة. يزوّد النتروجين عادةً في أسطوانات غاز مضغوط، ويرمز لها عندما تكون نقية وخالية من الأكسجين برمز OFN وذلك من oxygen-free nitrogen،[14] والتي يمكن أن تصل درجة نقاوتها إلى 99.99999%. يحصل على النتروجين عالي النقاوة، والذي تكون فيه نسبة الشوائب من الغازات أقل من 1 جزء في البليون (ppb)، عن طريق تكرار عملية الامتزاز/الانتزاز على الزيوليت.
يحضّر غاز النتروجين مخبرياً من المعالجة الحرارية لمحلول مائي من نتريت الأمونيوم أو محلول مائي لمزيج من كلوريد الأمونيوم مع نتريت الصوديوم:[15]
- NH4Cl + NaNO2⟶ NaCl + 2 H2O + N2↑{displaystyle mathrm {NH_{4}Cl + NaNO_{2}longrightarrow NaCl + 2 H_{2}O + N_{2}uparrow } }
تعطي طريقة التحضير هذه شوائب بكميات قليلة من غاز أحادي أكسيد النتروجين NO وحمض النتريك HNO3، والتي يمكن إزالتها بتمرير الغاز في محلول من ثنائي كرومات البوتاسيوم في حمض الكبريتيك.[15]
يمكن الحصول على غاز النتروجين بشكل نقي جداً في المختبر من إجراء عملية تفكك حراري لمركب أزيد الباريوم أو أزيد الصوديوم:[16][17]
- 2 NaN3 ⟶ΔT 2 Na + 3 N2{displaystyle mathrm {2 NaN_{3} } mathrm {{stackrel {Delta T}{longrightarrow }} 2 Na + 3 N_{2}} }
النظائر
هناك نظيرين مستقرين للنتروجين وهما نتروجين-14 14N و نتروجين-15 15N، لكن الوفرة الطبيعية الأكبر هي للنظير 14N، والتي تبلغ 99.634%. إن التفاعلات الحيوية مثل التمثّل والنترجة ونزع النتروجين تتحكم بنسب نظائر النتروجين الطبيعية في التربة، حيث تعمد تلك التفاعلات على تخصيب 15N في الركيزة وتقلله في الناتج.[18] أما في الغلاف الجوي، فإن هناك نسبة بسيطة من النتروجين الجزيئي يكون فيه كل من النظيرين الطبيعيين 14N15N موجودين (0.73%)، أما الباقي فهو تقريباً بالكامل من 14N2.[19]
توجد أيضاً نظائر مصطنعة للنتروجين، يتراوح عدد الكتلة فيها بين 12 - 19، ومن بينها النظير نتروجين-13 13N، الذي يبلغ عمر النصف له عشر دقائق، أما باقي النظائر المصطنعة فلها عمر نصف من مرتبة عدة ثوان أو أقل.[20] يحضّر 16N من النظير أكسجين-16 16O في الماء، وله نصف عمر حوالي 7.1 ثانية،[20] ويصدر عند اضمحلاله أشعة غاما ذات طاقة مرتفعة تتراوح بين 5-7 ميغاإلكترون فولت.[20][21] يستخدم 16N كمبرّد في مفاعل الماء المضغوط ومفاعل الماء المغلي.[21]
الخواص الفيزيائية

توهج غاز النتروجين داخل أنبوب تفريغ
في الشروط العادية من الضغط ودرجة الحرارة، فإن النتروجين الجزيئي هو عبارة عن غاز عديم اللون والرائحة والمذاق، وغير قابل للاشتعال. يتكثف النتروجين ويتسيّل عند -196 °س (77 كلفن) ليصبح سائلاً عديم اللون (النتروجين السائل)، وهو سائل أقل كثافة من الماء (0.808 غ/مل)، ويستخدم في التبريد العميق.[22] يتجمّد النتروجين السائل عند −210 °س (63 كلفن)،[23] وذلك إلى شكل متآصل بلوري متراص، والذي يأخذ يتحول إلى الشكل المتآصل البلوري المكعب عند −237.6 °س (35.4 كلفن)، والذي يعرف باسم الطور ألفا.[24] إن النقطة الحرجة للنتروجين هي عند درجة حرارة مقدارها −146.95 °س وضغط 33.9 بار، وتكون الكثافة الحرجة 0.314 غ/سم3. إن انحلالية غاز النتروجين في الماء ضعيفة، وهي تبلغ 23.2 مغ/ل عند الدرجة 0 °س.
حضّرت متآصلات غير مستقرة للنتروجين مخبرياً، وكانت تتألف من جزيئات ذات أكثر من ذرتي نتروجين مثل N3 (ثلاثي النتروجين) و N4 (رباعي النتروجين).[25] عند ضغوط مرتفعة جداً (حوالي 1.1 مليون وحدة ضغط جوي) ودرجات حرارة مرتفعة (2000 كلفن) فإنه يمكن الحصول على صيغ بلورية بوليمرية من النتروجين، والتي لها بنية بلورية شبيهة بالألماس مثل N4 (رباعي النتروجين)، والذي يعرف باسم الألماس النتروجيني.[26][27] من المتآصلات النظرية للننتروجين كل من N6، الذي يعرف باسم هكسازين، وهو متآصل افتراضي للنتروجين ترتبط فيه الذرات بشكل مشابه لارتباط ذرات الكربون في البنزين،[28] بالإضافة إلى N8، الذي يعرف باسم أوكتاآزاكوبان (ثماني آزا الكوبان)، وهو متآصل افتراضي للنتروجين ترتبط فيه ذرات النتروجين على شكل فراغي يشبه المكعب، وذلك بشكل مشابه لارتباط ذرات الكربون في الكوبان.[29] تشير الحسايات النظرية أن N6 غير مستقر بشكل كبير، في حين أنه يتوقع أن يكون N8 مستقر حركياً، وذلك بسبب تناظر المدارات الجزيئية.[30]
في أنبوب تفريغ يمكن لغاز النتروجين أن يتوهج وذلك تحت الشروط التالية: أن تكون تخلية الأنبوب بضغط يتراوح بين 5-10 ميلي بار، وجهد عالي حوالي 1.8 كيلوفولت، وشدة تيار تصل إلى 18 ميلي أمبير، وتردد يبلغ 35 كيلوهرتز. عند تلك الشروط تحدث عودة ارتباط لجزيئات الغاز المؤينة، ويصدر طيف لوني مميز للنتروجين.[31] إن النتروجين الجزيئي (14N2) ذو شفافية بالنسبة للأشعة المرئية وتحت الحمراء، لأنه جزيء متجانس مكوّن من نفس الذرة، وبالتالي لا يوجد عزم ثنائي قطب قادر على التأثر مع الإشعاع الكهرومغناطيسي عند أطوال الموجة تلك. بالمقابل، يحدث هناك امتصاص في مجال الأشعة فوق البنفسجية،[32] وذلك عند أطوال موجة حوالي 100 نانومتر. يترافق ذلك مع حدوث انتقالات إلكترونية في الجزيء إلى حالات تكون فيها الغمامة الإلكترونية غير متساوية التوزيع بين ذرتي النتروجين، مما يؤدي إلى الاستقطاب. يحدث هذا الامتصاص للأشعة فوق البنفسجية من جزيئات النتروجين في طبقات الجو العليا في الأرض وغيرها من الكواكب. يؤدي امتصاص الأشعة فوق البنفسجية والأشعة الكونية من جزيئات غاز النتروجين في طبقات الجو العليا إلى حدوث وهج جوي مرئي، وهو ناتج عن انفصام الرابطة الجزيئية وتشكل النتروجين الذري، والذي يرتبط بدوره مع الأكسجين ليشكل جزيئات أحادي أكسيد النتروجين (NO).
الخواص الكيميائية

طول الرابطة في النتروجين الجزيئي N2
يصنّف عنصر النتروجين ضمن اللافلزات، وله كهرسلبية مقدارها 3.04.[33] هناك خمس إلكترونات موجودة في غلاف التكافؤ الخارجي للذرّة، وذلك حسب التوزيع الإلكتروني 2s2p3، بالتالي حسب قاعدة الثمانيات، فإن النتروجين هو ثلاثي التكافؤ في أغلب مركباته، والتي تكون جلّها ذات صفة تساهمية. إن النتروجين هو العنصر الوحيد في مجموعته، مجموعة النتروجين، القادر على الارتباط بنفسه،[34] ويبلغ طول الرابطة الثلاثية بين الذرتين (N≡N) في النتروجين الجزيئي 109.76 بيكومتر، وهي واحدة من أقوى الروابط الكيميائية، إذ أن طاقة تفككها تصل إلى 942 كيلوجول/مول،[35] مما يعني أنه تلزم طاقة تنشيط مرتفعة لكسر تلك الرابطة وللارتباط مع عناصر أخرى.
إن النتروجين على العموم غير نشيط كيميائياً عند الدرجات العادية من الضغط ودرجة الحرارة، إلا في حال كان المتفاعل ذو نشاط كيميائي كبير. على سبيل المثال، يتفاعل النتروجين مع فلز الليثيوم ليعطي مركب نتريد الليثيوم:[36][37]
- 6 Li +N2 →100∘C 2 Li3N{displaystyle mathrm {6 Li +N_{2} {xrightarrow {100^{circ }C}} 2 Li_{3}N} }

بنية 2+[(Ru(NH3)5(N2]
يقوم النتروجين بالدخول على شكل ناتج إضافة مع العديد من الفلزات الانتقالية، ويسمى الناتج حينها باسم معقد تناسقي ثنائي النتروجين، وكمثال على ذلك المعقد التالي مع الروثينيوم 2+[(Ru(NH3)5(N2]، كما تبدو بنيته في الشكل المرفق. تجدر الإشارة إلى أن ربيطة N2 لا يتم الحصول عليها من الارتباط المباشر مع النتروجين الجزيئي، إنما من تفكك الهيدرازين. هناك معقدات أخرى على ذات النسق مثل IrCl(N2)(PPh3)2 و W(N2)2(Ph2PCH2CH2PPh2)2. توضح هذه المعقدات أن النتروجين الجزيئي N2 يمكن أن يرتبط مع الفلزات في إنزيم نتروجيناز ومع الحفاز في عملية هابر-بوش.[38]
كانت عملية هابر-بوش لاصطناع الأمونياك من النتروجين والهيدروجين البوابة التي مكّنت من تثبيت النتروجين صناعياً في المركبات الكيميائية. تتم العملية عادة باستخدام حفاز من أكسيد الحديد الثنائي والثلاثي Fe3O4 عند درجات حرارة حوالي 500 °س وضغط مقداره 200 وحدة ضغط جوي. هناك طرق أخرى لاختزال النتروجين إلى الأمونياك، مثل استخدام حفاز من معقد للموليبدنوم بوجود وسط مانح للبروتونات.[37]
المركبات الكيميائية
يعد الأمونياك (NH3) من أكثر مركبات النتروجين أهمية، وهو ينتج من عملية تثبيت النتروجين الصناعية من خلال عملية هابر-بوش، وهو يصنف كيميائياً على أنه هيدريد للنتروجين. من الهيدريدات الأخرى للنتروجين مركب الهيدرازين N2H4. للأمونياك خواص قاعدية، وهو ينحل في الماء مشكلاً أيونات الأمونيوم +NH4، كما يشكل أيونات الأميد -NH2، والنتريد -N3، ولها أملاح معروفة. من الأنيونات الأخرى مركبات الأزيد -N3، والتي لها بنية جزيئية خطية ومتساوية إلكترونياً مع ثنائي أكسيد الكربون، وهي من المركبات السامة مثل مركبات السيانيد. يرتبط النتروجين مع الهالوجينات ليشكل مركبات ثلاثي هاليد النتروجين والتي تشمل ثلاثي فلوريد النتروجين NF3وثلاثي كلوريد النتروجين NCl3وثلاثي بروميد النتروجين NBr3وثلاثي يوديد النتروجين NI3.
هناك عدة أكاسيد للنتروجين، والتي يشار إليها اختصاراً بالرمز NOx. من هذه الأكاسيد أكسيد النتروز (أحادي أكسيد ثنائي النتروجين N2O)، والذي يسمى غاز الضحك، وله تأثير تخديري. هناك أيضاً أكسيد النتريك (أحادي أكسيد النيتروجين NO)، وهو جذر كيميائي حر يستخدم في توصيل الإشارة عند النباتات والحيوانات. يكون ثنائي أكسيد النتروجين على شكل غاز أحمر اللون، وهو سام ويدخل في تركيب الضبخان. إن الأكاسيد المذكورة (الدنيا) للنتروجين هي أكاسيد مستقرة، في حين أن الأكاسيد العليا مثل ثلاثي أكسيد ثنائي النتروجين N2O3ورباعي أكسيد ثنائي النتروجين N2O4وخماسي أكسيد ثنائي النتروجين N2O5 هي غير مستقرة وتتفكك لتطلق غاز النتروجين N2.
تميل أكاسيد النتروجين إلى الانحلال في الماء، حيث يعطي أحادي أكسيد النتروجين عند انحلاله حمض النتروز HNO2، والذي ينتج أملاح النتريت، بالمقابل، فإن ثنائي أكسيد النتروجين يعطي عند انحلاله في الماء حمض النتريك HNO3، والذي ينتج أملاح النترات. من أحماض النتروجين أيضاً هناك حمض تحت النتروز H2N2O2، والذي تدعى أملاحه باسم تحت نتريت (هيبونتريت). يدخل النتروجين مع الكربون في تركيب حمض هيدروسيانيك، وعندما يضاف إليه الأكسجين نحصل على مجموعة من أحماض هيدروكسوسيانيك والأملاح الموافقة، مثل حمض السيانيك H-O-C≡N وأملاحه من السيانات، وحمض إيزوسيانيك O=C=N-H وأملاحه من إيزوسيانات، حمض الفلمنيك H-C≡N-O وأملاحه من الفلمينات.
يدخل النتروجين في تركيب العديد من المركبات العضوية مثل الأمينات والأحماض الأمينية والبروتينات والببتيدات والأميدات ومركبات النترو ومركبات الآزو والنتريلات والإيمينات والإينامينات، بالإضافة إلى المركبات الحلقية غير المتجانسة النتروجينية.
الدور الحيوي
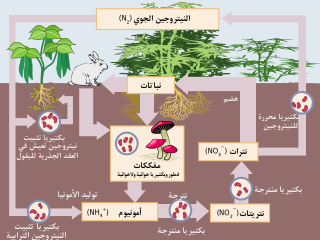
مخطط توضيحي لدورة النيتروجين تم إهمال تثبيت النيتروجين للاأحيائي.
إن النتروجين هو من العناصر المهمة لوجود الحياة على سطح الأرض، إذ أنه يدخل في تركيب الأحماض الأمينية والنووية.[8] لا يمكن للنباتات أو الحيوانات أن تحصل على عنصر النتروجين من الغلاف الجوي مباشرة، حيث ينبغي الحصول عليه على شكل مركبات، بعملية تدعى تثبيت النتروجين. تعد الهطولات على اختلافها أحد المصادر الطبيعية التي تجلب كميات من الأمونيوم والنترات إلى سطح الأرض، وذلك أثناء تشكلها في طبقات الجو عند حدوث البرق.[39] إن أغلب النتروجين المثبّت الموجود في التربة والذي يصل إلى جذور النباتات يكون على شكل نترات، في حين أن الأمونيوم يستهلك من نباتات الظلة.[40]
هناك أنواع خاصة من البكتريا (مثل ريزوبيا Rhizobium trifolium) لها القدرة على تثبيت النتروجين، وذلك بسبب وجود إنزيم نتروجيناز، والذي يستطيع تحويل غاز النتروجين إلى شكل الأمونيوم الكثر فائدة بالنسبة للمتعضيات العليا. يمكن لهذه البكتريا أن تعيش بشكل منفرد وحر في التربة مثل الآزوتية، ولكنها عادة ما تدخل في علاقة تعايش في العقد الجذرية في النباتات البقلية (مثل الفول والنفل وغيرها)، في بعض النباتات من الفصائل الأخرى مثل النغت وكازارينا والنباتات الكبدية.[41] يقوم مبدأ التعايش هنا على تقديم البكتريا للنتروجين على شكل مثبت، والذي يكون غالباً على شكل أمونيوم، والذي يحول في النبات إلى أحماض أمينية لتشكيل البروتينات وجزيئات حيوية أخرى. بالمقابل، فإن النبات يفرز السكر إلى البكتريا كي تؤمن غذائها.[41]
تستطيع النباتات أن تستفيد من النتروجين على شكل نترات بشكل مباشر، والذي يمكن أن يكون موجوداً في التربة من الترسبات الطبيعية للمعادن، أو من الأسمدة التركيبية، أو من فضلات الحيوانات، أو من التحلل العضوي. تتحوّل كمية النترات الممتصة على هذه الشاكلة إلى نتريت عن طريق إنزيم نترات ريدوكتاز (مختزل النترات)، ومن ثم يتحول إلى الأمونياك عن طريق إنزيم آخر وهو نتريت ريدوكتاز (مختزل النتريت).[41]
إن مركبات النتروجين مهمة جداً وأساسية في التركيب الحيوي للنباتات والحيوانات. تستخدم الحيوانات الأحماض الأمينية الحاوية على النتروجين من مصادر نباتية كأساس لكافة التفاعلات الكيميائية الحيوية المعتمدة على النتروجين، مثل اصطناع البروتينات والأحماض النووية. تكون الحشرات التي تتغذى على النباتات معتمدة على كمية النتروجين في نظامها الغذائي، بحيث أنه في حال تغيير كمية السماد الآزوتي المقدم إلى النبات فإن ذلك يؤثر على معدل التناسل لتلك الحشرات المتغذية على ذلك النبات.[42] للجذر الكيميائي الحر أكسيد النتريك NO دوراً مهماً في فيزيولوجيا الحيوانات.[43]
يؤدي استقلاب البروتينات الحاوية على النتروجين عند الحيوانات إلى إخراج (الإفراغ) على شكل يوريا، أما استقلاب الأحماض النووية فيعطي بالإضافة إلى اليوريا مركب حمض اليوريك. إن الرائحة المميزة لتحلل اللحم الحيواني يعود إلى تشكل مركبات أمينية طويلة السلسلة مثل بوتريسكين وكادافيرين، والتي هي بدورها نواتج تكسير الأحماض الأمينية أورنيثين ولايسين، على الترتيب، وذلك من البروتينات المتحللة.[44]
يعطي التحلل الحيوي في النهاية النتروجين على شكل غاز N2 والذي يعود إلى الغلاف الجوي ليغلق ما يسمى دورة النتروجين.[41]
الاستخدامات
للنتروجين العديد من التطبيقات المهمة، سواءً إن كان بالحالة الغازية أو بالحالة السائلة.
غاز النتروجين
يستخدم غاز النتروجين كغاز خامل، وذلك عند الحاجة إلى وسط بديل عن الهواء عندما تكون تفاعلات أكسدة-اختزال غير مرغوبة.[8] من الأمثلة على ذلك في المجال الصناعي استخدام غاز النتروجين في مزيج مع غاز ثنائي أكسيد الكربون كمادة حافظة للأغذية. يعد النتروجين النقي أحد الإضافات الغذائية ويحمل رقم إي E941.[45][46] من الأمثلة الأخرى لاستخدام النتروجين كغاز خامل دخوله في ملء المصابيح المتوهجة كبديل رخيص الثمن عن الآرغون.[47]
يستخدم النتروجين في صناعة الفولاذ،[48] ويستخدم في بعض أنظمة وقود الطائرات من أجل تخفيف خطر اشتعال الوقود، فيما يدعى باسم أنظمة التخميل،[49] كما يستخدم في ملء إطارات عجلات الطائرات وسيارات السباق.[50] يعود السبب في ذلك إلى النتروجين النقي يقي بخموله الكيميائي من أخطار حدوث انفجارات أثناء الإقلاع والهبوط أو أثناء ارتفاع درجات الحرارة نتيجة الاحتكاك.
في العمل المخبري الكيميائي يستخدم النتروجين في مجال تحضير العينات، حيث يستخدم للتجفيف من أجل تركيز العينات عن طريق إنقاص الحجم بتمرير تيار من النتروجين المضغوط على سطح العينة السائلة.[51]
يدخل النتروجين في تفاعل تحضير سياناميد الكالسيوم وذلك حسب المعادلة:
- CaC2+N2⟶ Ca(CN)2⟶ Ca2+ −N=C=N− +C{displaystyle mathrm {CaC_{2}+N_{2}longrightarrow Ca(CN)_{2}longrightarrow Ca^{2+} ^{-}N=C=N^{-} +C} }

نتروجين سائل ضمن إناء معدني.
النتروجين السائل
يعد النتروجين السائل أحد أشهر وسائل المبردات في التبريد العميق. وغالباً ما يستخدم في المختبرات الكيميائية وينقل في إناء ديوار، وذلك من دون حدوث تبخر كبير.[52] مثل الثلج الجاف، يستخدم النتروجين السائل في مجال التثليج، فعلى سبيل المثال يستخدم من أجل الحفظ بالتجميد للعينات الحيوية مثل الدم والنطاف والبويضات، ومن أجل العلاج بالتبريد لبعض الحالات الجلدية مثل الثآليل.[53] يستخدم النتروجين السائل أيضاً في تجهيز المصيدة الباردة في بعض المختبرات، وفي تبريد وحدة المكشاف في أجهزة الفحص المخبرية مثل أجهزة الأشعة تحت الحمراء والأشعة السينية. من التطبيقات الأخرى للنتروجين السائل استخدامه من أجل تبريد وحدة المعالجة المركزية للحواسيب الفائقة الضخمة.[54]
مركبات النتروجين
إن القدرة على الحصول على مركبات من النتروجين هي واحدة من العمليات المهمة، إذ أنه حتى بداية القرن العشرين، كانت الإمكانية الوحيدة لحدوث ذلك هي عن طريق طبيعي فقط، وذلك عن طريق المتعضيات والبكتريا. وكان الأسلوب الوحيد للحصول تلك المركبات من معالجة الترسبات الطبيعية مثل ملح النتر. تغيرت الأمور مع تطور العمليات الصناعية الكيميائية مثل عملية فرانك-كارو لإنتاج السياناميد، وعملية أوستفالد من إجل إنتاج حمض النتريك وأملاح النترات من الأمونياك،[8] ومن ثم عملية هابر-بوش لإنتاج الأمونياك.[23]
كانت الأملاح العضوية واللاعضوية لحمض النتريك تاريخياً أحد المصادر المهمة في الصناعات المختلفة. على سبيل المثال، كان مركب نترات البوتاسيوم مستخدماً بكثرة في صناعة البارود،[8] أما نترات الأمونيوم فكان بستخدم في صناعة الأسمدة والمتفجرات.[8] هناك العديد من المركبات العضوية المنترجة والتي كانت تستخدم في صناعة المتفجرات، مثل نتروغليسرين وثلاثي نترو التولوين (TNT)،[8] بالإضافة إلى نتروسيليلوز.[55] يستخدم حمض النتريك كمؤكسد في الصواريخ العاملة على الوقود السائل، أما الهيدرازين ومشتقاته فتستخدم كمواد دافعة أحادية.
وجد لأكسيد النتروز (غاز الضحك N2O) خواص مخدرة منذ القرن التاسع عشر، وهو يستعمل إلى الآن في بعض الحالات الجراحية. يدخل النتروجين في تركيب عدد كبير جداً من العقاقير والأدوية على شكل مركبات عضوية بمجموعات وظيفية مختلفة، وخاصة أشباه القلويات الموجودة في العقاقير المستخلصة من النباتات.
احتياطات الأمان
إن الإطلاق السريع لغاز النتروجين في حجرة أو مكان مغلق يمكن أن يزيح الأكسجين، مما يشكل بالتالي خطر الاختناق، ويحدث ذلك مع وجود أعراض محذّرة قليلة، إذ أن الجسم السباتي في جسم الإنسان ذو نظام استشعاري بطيء نسبياً لنقص الأكسجين.[56]
إن استنشاق غاز النتروجين عند ضغوط جزئية مرتفعة (أكثر من 4 بار، والتي يمكن أن تصادف عند أعماق دون 30 متر تحت سطح البحر في غوص سكوبا) له تأثير تخديري، فيما يعرف باسم تخدير الأعماق، حيث يشعر الغواص بفقدان جزئي للوعي، شبيهة بالتي تحصل عند استنشاق أكسيد النتروس.[57][58] يستطيع النتروجين أن ينحل في مجرى الدم وفي الدهون داخل الجسم. يؤدي تخفيض الضغط المفاجئ، وخاصة في حالة الصعود السريع إلى السطح عند الغواصين، إلى حدوث حالة مرضية خطيرة تعرف باسم مرض تخفيف الضغط، والذي تتشكل فيه فقاعات من غاز النتروجين في مجرى الدم والأعصاب ومناطق حيوية أخرى في الجسم.[59][60]
يؤدي التلامس المباشر للجلد مع النتروجين السائل إلى حدوث عضة برد (تثليج)، والتي يمكن أن تحدث فوراً، أو تأخذ عدة ثوان، وذلك حسب درجة حرارة السائل. لذلك يجب الانتباه وارتداء قفازات ووسائل الحماية المخبرية عند التعامل مع النتروجين السائل. تستخدم حساسات أكسجين في بعض الأحيان كوسيلة وقاية عند العمل بالنتروجين السائل وذلك من أجل تنبيه العمال عند حدوث انسكاب في مكان محصور.[61]
المراجع
^ Lavoisier, Antoine Laurent (1965). Elements of chemistry, in a new systematic order: containing all the modern discoveries. Courier Dover Publications. صفحة 15. ISBN 0-486-64624-6. الوسيط|الصفحة=تم تجاهله (مساعدة); الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|الرقم المعياري=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|وصلة المؤلف=تم تجاهله (مساعدة)
^ Weeks، Mary Elvira (1932). "The discovery of the elements. IV. Three important gases". Journal of Chemical Education. 9 (2): 215. Bibcode:1932JChEd...9..215W. doi:10.1021/ed009p215. الوسيط|الصفحة=تم تجاهله (مساعدة); الوسيط|التاريخ=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة); الوسيط|الأخير1=تم تجاهله (مساعدة)
^ Aaron J. Ihde, The Development of Modern Chemistry, New York 1964.
^ Elements of Chemistry, trans. Robert Kerr (Edinburgh, 1790; New York: Dover, 1965), 52.
^ nitrogen. Etymonline.com. Retrieved on 2011-10-26. نسخة محفوظة 02 يوليو 2017 على موقع واي باك مشين.
^ Lord Rayleigh's Active Nitrogen. Lateralscience.co.uk. Retrieved 2011-10-26.
^ Erisman، Jan Willem؛ Sutton، Mark A.؛ Galloway، James؛ Klimont، Zbigniew؛ Winiwarter، Wilfried (2008). "How a century of ammonia synthesis changed the world". Nature Geoscience. 1 (10): 636. Bibcode:2008NatGe...1..636E. doi:10.1038/ngeo325. الوسيط|الأخير4=تم تجاهله (مساعدة); الوسيط|الأول3=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأخير5=تم تجاهله (مساعدة); الوسيط|الأول4=تم تجاهله (مساعدة); الوسيط|الأخير3=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة); الوسيط|الأخير1=تم تجاهله (مساعدة); الوسيط|الأخير2=تم تجاهله (مساعدة); الوسيط|الصفحة=تم تجاهله (مساعدة); الوسيط|الأول5=تم تجاهله (مساعدة); الوسيط|الأول2=تم تجاهله (مساعدة)
↑ أبتثجحخ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New ed.). pages:360-364, New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
↑ أب Croswell، Ken (February 1996). Alchemy of the Heavens. Anchor. ISBN 0-385-47214-5. الوسيط|الرقم المعياري=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|الأول=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|الأخير=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة)
^ Bethe، H. A. (1939). "Energy Production in Stars". Physical Review. 55 (5): 434–56. Bibcode:1939PhRv...55..434B. doi:10.1103/PhysRev.55.434. الوسيط|التاريخ=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|الأول=تم تجاهله (مساعدة); الوسيط|الأخير=تم تجاهله (مساعدة)
^ Meyer, Daved M.؛ Cardelli, Jason A.؛ Sofia, Ulysses J. (1997). "Abundance of Interstellar Nitrogen". The Astrophysical Journal. 490: L103–L106. Bibcode:1997ApJ...490L.103M. arXiv:astro-ph/9710162 . doi:10.1086/311023. الوسيط
. doi:10.1086/311023. الوسيط |المؤلف=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|المؤلف2=تم تجاهله (مساعدة); الوسيط|المؤلف3=تم تجاهله (مساعدة)
^ Hamilton, Calvin J. "Titan (Saturn VI)". Solarviews.com. اطلع عليه بتاريخ 24 ديسمبر 2007. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|تاريخ الوصول=تم تجاهله (مساعدة)
^ Lincoln Taiz, Eduardo Zeiger: Physiologie der Pflanzen. Spektrum, Akad. Verlag, Heidelberg/Berlin 2000, ISBN 3-8274-0537-8.(بالألمانية)
^ Reich، Murray.؛ Kapenekas، Harry. (1957). "Nitrogen Purfication. Pilot Plant Removal of Oxygen". Industrial & Engineering Chemistry. 49 (5): 869–873. doi:10.1021/ie50569a032. الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة); الوسيط|الأول2=تم تجاهله (مساعدة); الوسيط|الأخير2=تم تجاهله (مساعدة); الوسيط|الأخير1=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة)
↑ أب Bartlett، J. K. (1967). "Analysis for nitrite by evolution of nitrogen: A general chemistry laboratory experiment". Journal of Chemical Education. 44 (8): 475. Bibcode:1967JChEd..44..475B. doi:10.1021/ed044p475. الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة); الوسيط|الأخير1=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة)
^ Eremets، M. I.؛ Popov، M. Y.؛ Trojan، I. A.؛ Denisov، V. N.؛ Boehler، R.؛ Hemley، R. J. (2004). "Polymerization of nitrogen in sodium azide". The Journal of Chemical Physics. 120 (22): 10618–10623. Bibcode:2004JChPh.12010618E. PMID 15268087. doi:10.1063/1.1718250. الوسيط|الأخير4=تم تجاهله (مساعدة); الوسيط|الأول3=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأول2=تم تجاهله (مساعدة); الوسيط|الأول4=تم تجاهله (مساعدة); الوسيط|الأخير3=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|الأول5=تم تجاهله (مساعدة); الوسيط|الأخير2=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|الأخير5=تم تجاهله (مساعدة); الوسيط|الأخير1=تم تجاهله (مساعدة)
^ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 457–460.
^ Flanagan، Lawrence B.؛ Ehleringer، James R؛ Pataki، Diane E. (15 December 2004). Stable Isotopes and Biosphere - Atmosphere Interactions: Processes and Biological Controls. صفحات 74–75. ISBN 9780080525280. الوسيط|المؤلف1=تم تجاهله (مساعدة); الوسيط|الأول3=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|الأخير3=تم تجاهله (مساعدة); الوسيط|الأول2=تم تجاهله (مساعدة); الوسيط|الرقم المعياري=تم تجاهله (مساعدة); الوسيط|الأخير2=تم تجاهله (مساعدة)
^ "Atomic Weights and Isotopic Compositions for Nitrogen". NIST. اطلع عليه بتاريخ 22 مايو 2013. الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة)
↑ أبت Audi, G.؛ Wapstra, A. H.؛ Thibault, C.؛ Blachot, J. & Bersillon, O. (2003). "The NUBASE evaluation of nuclear and decay properties" (PDF). Nuclear Physics A. 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|المؤلف3=تم تجاهله (مساعدة); الوسيط|المؤلف2=تم تجاهله (مساعدة); الوسيط|المؤلف4=تم تجاهله (مساعدة); الوسيط|المؤلف5=تم تجاهله (مساعدة)
↑ أب Neeb، Karl Heinz (1997). The Radiochemistry of Nuclear Power Plants with Light Water Reactors. Berlin-New York: Walter de Gruyter. صفحة 227. ISBN 3-11-013242-7. الوسيط|الصفحة=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأول=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|الرقم المعياري=تم تجاهله (مساعدة); الوسيط|الأخير=تم تجاهله (مساعدة); الوسيط|المكان=تم تجاهله (مساعدة)
^ Iancu، C. V.؛ Wright، E. R.؛ Heymann، J. B.؛ Jensen، G. J. (2006). "A comparison of liquid nitrogen and liquid helium as cryogens for electron cryotomography". Journal of Structural Biology. 153 (3): 231–240. PMID 16427786. doi:10.1016/j.jsb.2005.12.004. الوسيط|الأخير4=تم تجاهله (مساعدة); الوسيط|الأول3=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأول4=تم تجاهله (مساعدة); الوسيط|الأخير3=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة); الوسيط|الأخير1=تم تجاهله (مساعدة); الوسيط|الأخير2=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|الأول2=تم تجاهله (مساعدة)
↑ أب Gray، Theodore (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2. الوسيط|الرقم المعياري=تم تجاهله (مساعدة); الوسيط|المكان=تم تجاهله (مساعدة); الوسيط|الأول=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|الأخير=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة)
^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0-08-037941-9.
^ "A new molecule and a new signature – Chemistry – tetranitrogen". Science News. 16 February 2002. اطلع عليه بتاريخ 18 أغسطس 2007. الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|التاريخ=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|العمل=تم تجاهله (مساعدة)
^ "Polymeric nitrogen synthesized". physorg.com. 5 August 2004. تمت أرشفته من الأصل في 24 يناير 2012. اطلع عليه بتاريخ 22 يونيو 2009. الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|مسار الأرشيف=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|تاريخ الأرشيف=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|التاريخ=تم تجاهله (مساعدة); تحقق من التاريخ في:|archive-date=(مساعدة)
^ Pressemitteilung der Max-Planck-Gesellschaft vom 3. August 2004(بالألمانية) نسخة محفوظة 03 يناير 2011 على موقع واي باك مشين.
^ Fabian, J. & Lewars, E. (2004). "Azabenzenes (azines)—The nitrogen derivatives of benzene with one to six N atoms: Stability, homodesmotic stabilization energy, electron distribution, and magnetic ring current; a computational study" (PDF). Canadian Journal of Chemistry. 82 (1): 50–69. doi:10.1139/v03-178. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|المؤلف2=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة)
^ Muir, B. Cubane. (See "further topics" section.) نسخة محفوظة 02 سبتمبر 2006 على موقع واي باك مشين.
^ Patil, Ujwala N.؛ Dhumal, Nilesh R. & Gejji, Shridhar P. (2004). "Theoretical studies on the molecular electron densities and electrostatic potentials in azacubanes". Theoretica Chimica Acta. 112: 27–32. doi:10.1007/s00214-004-0551-2. الوسيط|المؤلف3=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|المؤلف2=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|المؤلف=تم تجاهله (مساعدة)
^ Stickstoff Spektralröhre نسخة محفوظة 05 مارس 2016 على موقع واي باك مشين.
^ Worley، R. (1943). "Absorption Spectrum of N2 in the Extreme Ultraviolet". Physical Review. 64 (7–8): 207. Bibcode:1943PhRv...64..207W. doi:10.1103/PhysRev.64.207. الوسيط|الصفحة=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة); الوسيط|الأخير1=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة)
^ Lide, D. R., المحرر (2003). CRC Handbook of Chemistry and Physics (الطبعة 84th). Boca Raton, FL: CRC Press. الوسيط|المحرر=تم تجاهله (مساعدة); الوسيط|الإصدار=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|المكان=تم تجاهله (مساعدة)
^ E. Riedel؛ C. Janiak (2011)، Anorganische Chemie (الطبعة 8.)، de Gruyter، صفحة 464، ISBN 3110225662 الوسيط|الإصدار=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|الأخير1=تم تجاهله (مساعدة); الوسيط|الأخير2=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة)
^ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 653.
^ A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie 1995, 101. Auflage, de Gruyter. ISBN 3-11-012641-9, S. 1153.
↑ أب Schrock, R. R. (2005). "Catalytic Reduction of Dinitrogen to Ammonia at a Single Molybdenum Center". Acc. Chem. Res. 38 (12): 955–962. PMC 2551323 . PMID 16359167. doi:10.1021/ar0501121. الوسيط
. PMID 16359167. doi:10.1021/ar0501121. الوسيط |المؤلف=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة)
^ Fryzuk, M. D. & Johnson, S. A. (2000). "The continuing story of dinitrogen activation". Coordination Chemistry Reviews. 200–202: 379. doi:10.1016/S0010-8545(00)00264-2. الوسيط|الصفحة=تم تجاهله (مساعدة); الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|المؤلف2=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة)
^ Rakov، Vladimir A.؛ Uman، Martin A. (2007). Lightning: Physics and Effects. Cambridge University Press. صفحة 508. ISBN 978-0-521-03541-5. الوسيط|الصفحة=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة); الوسيط|الأخير1=تم تجاهله (مساعدة); الوسيط|الأخير2=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|الرقم المعياري=تم تجاهله (مساعدة); الوسيط|الأول2=تم تجاهله (مساعدة)
^ Jama، Bashir؛ Ndufa، J. K.؛ Buresh، R. J.؛ Shepherd، K. D. "Vertical Distribution of Roots and Soil Nitrate: Tree Species and Phosphorus Effects". 62 (1). Soil Science Society of America Journal: 280–286. اطلع عليه بتاريخ 02 يناير 2013. الوسيط|الأخير4=تم تجاهله (مساعدة); الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|الأول3=تم تجاهله (مساعدة); الوسيط|الأخير3=تم تجاهله (مساعدة); الوسيط|الأول2=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|الأخير1=تم تجاهله (مساعدة); الوسيط|الأخير2=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأول4=تم تجاهله (مساعدة)
↑ أبتث Bothe, Hermann؛ Ferguson, Stuart John؛ Newton, William Edward (2007). Biology of the nitrogen cycle. Elsevier. صفحة 283. ISBN 0-444-52857-1. الوسيط|الصفحة=تم تجاهله (مساعدة); الوسيط|المؤلف3=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|المؤلف2=تم تجاهله (مساعدة); الوسيط|الرقم المعياري=تم تجاهله (مساعدة); الوسيط|المؤلف=تم تجاهله (مساعدة)
^ Jahn, G.C.؛ Almazan، Liberty P.؛ Pacia، Jocelyn B. (2005). "Effect of nitrogen fertilizer on the intrinsic rate of increase of the rusty plum aphid, Hysteroneura setariae (Thomas) (Homoptera: Aphididae) on rice (Oryza sativa L.)". Environmental Entomology. 34 (4): 938–943. doi:10.1603/0046-225X-34.4.938. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|الأول3=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|الأخير3=تم تجاهله (مساعدة); الوسيط|الأول2=تم تجاهله (مساعدة); الوسيط|الأخير2=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة)
^ Knox, G. A. (2007). Biology of the Southern Ocean. CRC Press. صفحة 392. ISBN 0-8493-3394-6. الوسيط|الصفحة=تم تجاهله (مساعدة); الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الرقم المعياري=تم تجاهله (مساعدة)
^ Vickerstaff Joneja؛ Janice M. (2004). Digestion, diet, and disease: irritable bowel syndrome and gastrointestinal function. Rutgers University Press. صفحة 121. ISBN 0-8135-3387-2. الوسيط|الصفحة=تم تجاهله (مساعدة); الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|الرقم المعياري=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|المؤلف2=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة)
^ Ministers، Nordic Council of (2002). "Food Additives in Europe 2000": 591. ISBN 9789289308298. الوسيط|الصفحة=تم تجاهله (مساعدة); الوسيط|المؤلف1=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة)
^ ZZulV: قانون تنظيمي بالسماح باستخدام الإضافات في الصناعات الغذائية (بالألمانية) نسخة محفوظة 09 أكتوبر 2010 على موقع واي باك مشين.
^ Harding, Charlie, المحرر (2002). Elements of the p Block. Cambridge: Royal Society of Chemistry. ISBN 978-0-85404-690-4. الوسيط|المحرر=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|الرقم المعياري=تم تجاهله (مساعدة); الوسيط|المكان=تم تجاهله (مساعدة)
^ Gavriliuk, V. G.؛ Berns, Hans (1999). High nitrogen steels: structure, properties, manufacture, applications. Springer. ISBN 3-540-66411-4. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|الرقم المعياري=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|المؤلف2=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة)
^ "Centre Fuel Tank Inerting". B737.org.uk. اطلع عليه بتاريخ 21 أغسطس 2013. الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة)
^ "Why don't they use normal air in race car tires?". Howstuffworks. اطلع عليه بتاريخ 22 يوليو 2006. الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة)
^ Kemmochi, Y؛ Tsutsumi، K؛ Arikawa، A؛ Nakazawa، H (2002). "Centrifugal concentrator for the substitution of nitrogen blow-down micro-concentration in dioxin/polychlorinated biphenyl sample preparation". Journal of Chromatography A. 943 (2): 295–297. PMID 11833649. doi:10.1016/S0021-9673(01)01466-2. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|الأول3=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأول4=تم تجاهله (مساعدة); الوسيط|الأخير4=تم تجاهله (مساعدة); الوسيط|الأخير3=تم تجاهله (مساعدة); الوسيط|الأول2=تم تجاهله (مساعدة); الوسيط|الأخير2=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة)
^ Kaganer, M. G.؛ Kozheurov, V. & Levina, Zh. L. (1967). "Vessels for the storage and transport of liquid oxygen and nitrogen". Chemical and Petroleum Engineering. 3 (12): 918–922. doi:10.1007/BF01136404. الوسيط|المؤلف3=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|المؤلف2=تم تجاهله (مساعدة); الوسيط|المؤلف=تم تجاهله (مساعدة)
^ Ahmed I؛ Agarwal S؛ Ilchyshyn A؛ Charles-Holmes S؛ Berth-Jones J (May 2001). "Liquid nitrogen cryotherapy of common warts: cryo-spray vs. cotton wool bud". Br. J. Dermatol. 144 (5): 1006–9. PMID 11359389. doi:10.1046/j.1365-2133.2001.04190.x. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|التاريخ=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|المؤلف3=تم تجاهله (مساعدة); الوسيط|المؤلف2=تم تجاهله (مساعدة); الوسيط|المؤلف4=تم تجاهله (مساعدة); الوسيط|المؤلف5=تم تجاهله (مساعدة)
^ Kent, Allen؛ Williams, James G. (1994). Encyclopedia of Computer Science and Technology. 30. CRC Press. صفحة 318. ISBN 0-8247-2283-3. الوسيط|الصفحة=تم تجاهله (مساعدة); الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|المؤلف2=تم تجاهله (مساعدة); الوسيط|الرقم المعياري=تم تجاهله (مساعدة)
^ Cleveland, David (2002) "Don't Try This at Home: Some Thoughts on Nitrate Film, With Particular Reference to Home Movie Systems" in Roger Smither and Catherine Surowiec (eds.), This Film is Dangerous: A Celebration of Nitrate Film, Brussels, FIAF, ISBN 978-2-9600296-0-4, p. 196
^ "Biology Safety – Cryogenic materials. The risks posed by them.". University of Bath. اطلع عليه بتاريخ 03 يناير 2007. الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة)
^ Fowler، B.؛ Ackles، K.N.؛ Porlier، G. (1985). "Effects of inert gas narcosis on behavior—a critical review". Undersea Biomed. Res. 12 (4): 369–402. PMID 4082343. اطلع عليه بتاريخ 21 سبتمبر 2008. الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|الأول3=تم تجاهله (مساعدة); الوسيط|الأخير3=تم تجاهله (مساعدة); الوسيط|الأول2=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|الأخير1=تم تجاهله (مساعدة); الوسيط|الأخير2=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة)
^ Rogers, W. H.؛ Moeller, G. (1989). "Effect of brief, repeated hyperbaric exposures on susceptibility to nitrogen narcosis". Undersea Biomed. Res. 16 (3): 227–32. OCLC 2068005. PMID 2741255. اطلع عليه بتاريخ 21 سبتمبر 2008. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|المؤلف2=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة)
^ Acott، C. (1999). "A brief history of diving and decompression illness". South Pacific Underwater Medicine Society Journal. 29 (2). OCLC 16986801. اطلع عليه بتاريخ 21 سبتمبر 2008. الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|الأخير=تم تجاهله (مساعدة); الوسيط|الأول=تم تجاهله (مساعدة)
^ Kindwall، E. P.؛ Baz، A.؛ Lightfoot، E. N.؛ Lanphier، E. H.؛ Seireg، A. (1975). "Nitrogen elimination in man during decompression". Undersea Biomed. Res. 2 (4): 285–97. OCLC 2068005. PMID 1226586. اطلع عليه بتاريخ 21 سبتمبر 2008. الوسيط|الأخير4=تم تجاهله (مساعدة); الوسيط|الأول3=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|الأول2=تم تجاهله (مساعدة); الوسيط|الأخير5=تم تجاهله (مساعدة); الوسيط|الأول4=تم تجاهله (مساعدة); الوسيط|الأخير3=تم تجاهله (مساعدة); الوسيط|الأول1=تم تجاهله (مساعدة); الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|الأول5=تم تجاهله (مساعدة); الوسيط|الأخير2=تم تجاهله (مساعدة); الوسيط|السنة=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|الأخير1=تم تجاهله (مساعدة)
^ Liquid Nitrogen – Code of practice for handling. United Kingdom: Birkbeck, University of London. 2007. اطلع عليه بتاريخ 08 فبراير 2012. الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|المكان=تم تجاهله (مساعدة)
وصلات خارجية
- مقالة عن النتروجين (الآزوت) في الموسوعة العربية
الجدول الدوري | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
H | | He | ||||||||||||||||||||||||||||||||||||||||
Li | Be | | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
Na | Mg | | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
بوابة الكيمياء
|




