ملتاز
| Alpha-glucosidase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| أرقام التعريف | |||||||||
| رقم التصنيف الإنزيمي | 3.2.1.20 | ||||||||
| رقم التسجيل CAS | 9001-42-7 | ||||||||
| قواعد البيانات | |||||||||
| قاعدة بيانات الإنزيم | راجع IntEnz | ||||||||
| قاعدة بيانات براونشفايغ | راجع BRENDA | ||||||||
| إكسباسي | راجع NiceZyme | ||||||||
| موسوعة كيوتو | راجع KEGG | ||||||||
| ميتاسيك | المسار الأيضي | ||||||||
| بريام | ملف التعريف | ||||||||
| تركيب بنك بيانات البروتين | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
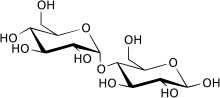
رد فعل المالتاز
مالتاز(بالإنجليزية: Maltase)هو إنزيم ينتمي لعائلة الفا جلوكوزيدات ،ويقوم بتحويل المالتوز إلى غلوكوز في عملية الهضم.
محتويات
1 الموقع
2 رد الفعل
3 المراجع
4 وصلات إضافية
الموقع
يتواجد في اللعاب وفي عصارة البنكرياس،وقد تم العثور على هذا الانزيم في النباتات والبكتيريا و الخميرة.[1][2]
رد الفعل
المالتاز هو الانزيم الذي يقوم بتحطيم المالتوز ديساكهارايد ، ويحفز على تحلل المالتوز إلى الغلوكوزات بسيطة السكر .[3][4][5][6] يتم تصنيف نقص حمض المالتاز إلى ثلاثة أنواع منفصلة على أساس سن بداية ظهور الأعراض في المصابين بها.
المراجع
^ "Maltase - Definition from the Merriam-Webster Online Dictionary". تمت أرشفته من الأصل في 12 أغسطس 2017. اطلع عليه بتاريخ 06 أبريل 2009. الوسيط|مسار الأرشيف=تم تجاهله (مساعدة); الوسيط|تاريخ الوصول=تم تجاهله (مساعدة); الوسيط|تاريخ الأرشيف=تم تجاهله (مساعدة); الوسيط|المسار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); تحقق من التاريخ في:|archive-date=(مساعدة).mw-parser-output cite.citation{font-style:inherit}.mw-parser-output .citation q{quotes:"""""""'""'"}.mw-parser-output .citation .cs1-lock-free a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/6/65/Lock-green.svg/9px-Lock-green.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .citation .cs1-lock-limited a,.mw-parser-output .citation .cs1-lock-registration a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Lock-gray-alt-2.svg/9px-Lock-gray-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .citation .cs1-lock-subscription a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Lock-red-alt-2.svg/9px-Lock-red-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration{color:#555}.mw-parser-output .cs1-subscription span,.mw-parser-output .cs1-registration span{border-bottom:1px dotted;cursor:help}.mw-parser-output .cs1-ws-icon a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/4/4c/Wikisource-logo.svg/12px-Wikisource-logo.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output code.cs1-code{color:inherit;background:inherit;border:inherit;padding:inherit}.mw-parser-output .cs1-hidden-error{display:none;font-size:100%}.mw-parser-output .cs1-visible-error{font-size:100%}.mw-parser-output .cs1-maint{display:none;color:#33aa33;margin-left:0.3em}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration,.mw-parser-output .cs1-format{font-size:95%}.mw-parser-output .cs1-kern-left,.mw-parser-output .cs1-kern-wl-left{padding-left:0.2em}.mw-parser-output .cs1-kern-right,.mw-parser-output .cs1-kern-wl-right{padding-right:0.2em}
^ Bruni, C.B., Sica, V., Auricchio, F. and Covelli, I. (1970). "Further kinetic and structural characterization of the lysosomal α-D-glucoside glucohydrolase from cattle liver". Biochim. Biophys. Acta. 212: 470–477. PMID 5466143. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|التاريخ=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة) صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
^ Flanagan, P.R. and Forstner, G.G. (1978). "Purification of rat intestinal maltase/glucoamylase and its anomalous dissociation either by heat or by low pH". Biochem. J. 173: 553–563. PMID 29602. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|التاريخ=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة) صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
^ Larner, J. (1960). "Other glucosidases". In Boyer, P.D., Lardy, H. and Myrbäck, K. The Enzymes. 4 (الطبعة 2nd). New York: Academic Press. صفحات 369–378. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|الإصدار=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة); الوسيط|المحرر=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|الناشر=تم تجاهله (مساعدة); الوسيط|المكان=تم تجاهله (مساعدة) صيانة CS1: أسماء متعددة: قائمة المحررون (link)
^ Sivikami, S. and Radhakrishnan, A.N. (1973). "Purification of rabbit intestinal glucoamylase by affinity chromatography on Sephadex G-200". Indian J. Biochem. Biophys. 10: 283–284. PMID 4792946. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|التاريخ=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة) صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
^ Sørensen, S.H., Norén, O., Sjöström, H. and Danielsen, E.M. (1982). "Amphiphilic pig intestinal microvillus maltase/glucoamylase. Structure and specificity". Eur. J. Biochem. 126: 559–568. PMID 6814909. الوسيط|المؤلف=تم تجاهله (مساعدة); الوسيط|الصفحات=تم تجاهله (مساعدة); الوسيط|التاريخ=تم تجاهله (مساعدة); الوسيط|العنوان=تم تجاهله (مساعدة) صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
وصلات إضافية
Maltases في المَكتبة الوَطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
- Structure and evolution of the mammalian maltase-glucoamylase and sucrase-isomaltase
| ||||||||||
بوابة علم الأحياء الخلوي والجزيئي
بوابة الكيمياء الحيوية
في كومنز صور وملفات عن: ملتاز
هذه بذرة مقالة عن بروتين بحاجة للتوسيع. شارك في تحريرها.